O alumínio é um metal de utilização essencial para nossas vidas, sendo usado em vários fatores da sociedade como na construção civil, nas industrias de produção de bens de consumo, nos transportes, entre outros. Esse uso intenso é devido a ele ser um material leve, flexível e de fácil reciclagem, considerando que os meios de transporte representam 19% da energia total gasta no mundo e quando são utilizados matérias leves como o o alumínio em sua construção o consumo de energia pode ser reduzido.
Ele tem esse uso em ampla escala devido as suas prorpiedades químicas tais como, baixa densidade, elevada resistência mecânica e a corrosão, alem de ter muita utilidade em ligas metálicas como a duralumínio, por exemplo.
No entanto, ele não é encontrado na natureza em sua forma elementar (Aℓ(s)), apenas quando combinado com outros elementos formando compostos como os minérios. O minério que é o principal possuidor do alumínio é a bauxita que contem oxido de alumínio hidratado (Aℓ2O3 . x H2O) e diversas impurezas.
Antes era feito um processo caro e ineficiente para a obtenção de alumínio através da alumina (Aℓ2O3) da bauxita, pois essa alumina possui um ponto de fusão de 2 mil graus Celsius, uma temperatura muito elevada.
Porém, a historia muda em 1996 quando o americano Charles M. Hall e o francês Paul Hérout desenvolvem o método que é usado até os dias de hoje para a produção de alumínio a partir da alumina. O método é chamado de Processo de Hall e se dá por meio da eletrólise.
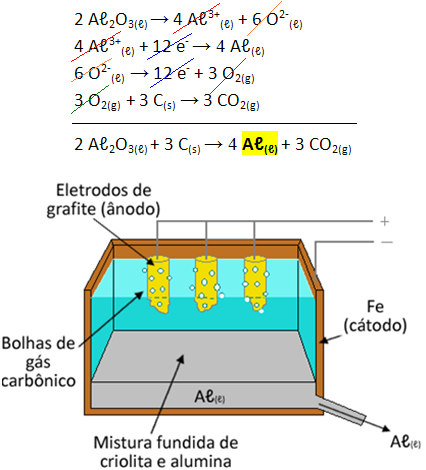
A grande descoberta deles foi que a criolita (Na3AℓF6) é atuante como fundente da alumina, ou seja, abaixa o seu ponto de fusão em cerca de mil graus Celsius Sendo assim, o processo de Hall consiste em colocar a mistura de alumina e criolita (Aℓ2O3 + Na3AℓF6) fundidas em um recipiente de ferro ou aço com eletrodos de carbono (carvão ou grafite) mergulhados na mistura. Devido a fundição, contem na mistura liquida íons Aℓ3+(ℓ) e O2-(ℓ) livres.
2 Aℓ2O3(ℓ) → 4 Aℓ3+(ℓ) + 6 O2-(ℓ)
O recipiente de aço atua como polo negativo (cátodo) onde ocorre a redução de cátions de alumínio:
Semirreação do cátodo: 4 Aℓ3+(ℓ) + 12 e- → 4 Aℓ(ℓ)
O aluminio formado permanece no estado líquido devido ao seu ponto de fusão ser menor que o da mistura de criolita e aluminia. Porém, já que a sua densidade é maior que a da mistura, ele desce para o fundo do recipiente onde é coletado por escoamento.
Após esse processo, o aluminio fundido é colocado em moldes, onde se solidifica.
Os eletrodos de carbono atuam como polos positivos (ânodos) onde há a oxidação dos ânions oxigênio:
Semirreação do ânodo: 6 O2-(ℓ) → 12 e- + 3 O2(g)
Esse gás oxigênio formado reage com o carbono do eletrodo e forma o gás carbônico (CO2(g)):
3 O2(g) + 3 C(s) → 3 CO2(g)
Assim, a equação global que ocorre nesse processo é dada por:





Nenhum comentário:
Postar um comentário